|
비보존은 신약후보물질 ‘VVZ-2471’의 경구제 신경병성 통증 임상 2상에 대한 임상시험계획(IND)을 식품의약품안전처에 신청했다고 25일 밝혔다.
이번 임상은 서울성모병원에서 대상포진 후 신경병성 통증 환자 90명을 대상으로 진행된다. 임상시험 책임자인 박휴정 마취통증학과 교수는 환자들에게 위약 또는 VVZ-2471을 4주간 하루 2회(100㎎, 150㎎) 투여하며 VVZ-2471의 진통 효능을 시험할 계획이다.
대상포진 후 신경통은 대상포진이 완치된 후에도 통증이 만성화되는 신경병성 질환으로 치료가 매우 어려운 것으로 알려져 있다.
이두현 비보존 대표는 “VVZ-2471은 경구용 진통제로서 오피란제린 주사제와 보완적으로 사용될 수 있다”며 “수술 직후에는 부작용으로 오심·구토가 심해 진통제를 경구로 복용하기 힘들기 때문에 주사제를 사용하고, 부작용이 줄어드는 시점부터는 VVZ-2471을 경구 투여하면서 수술 후 통증을 제어할 수 있다”고 설명했다.
이어 “이번에는 용량 결정 시험을 겸해 임상 진행 속도가 빠를 것으로 예상되는 신경병성 통증에 대해 먼저 임상을 진행하는 것”이라며 “수술 후 통증에 대해서도 임상 2상을 개시할 예정이다”고 덧붙였다.
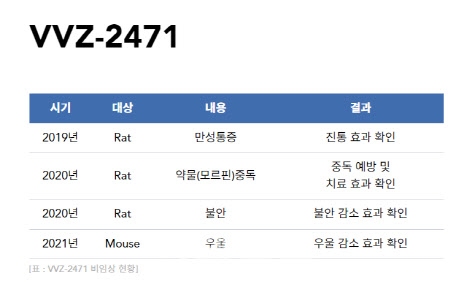
VVZ-2471은 비보존의 다중-타겟 신약발굴 원천기술로 발굴된 후보물질이다. 앞선 비임상 연구를 통해 급만성 통증 및 마약중독 치료에 대한 탁월한 효능이 입증됐다. 비보존은 지난해 분당서울대학교병원에서 진행된 VVZ-2471 임상 1상에서 400㎎ 캡슐을 하루 2회, 7일간 투여하는 용량에 대해 내약성과 안정성을 확인한 바 있다.
비보존은 VVZ-2471을 미국에서는 마약중독 치료제로 임상 2상을 진행할 계획이다
비보존 관계자는 “오는 5월 미국의 중독 치료 전문의들과 함께 미국 국립 약물남용연구소(NIDA)의 신약개발 지원사업에 지원할 예정”이라며 “해당 사업에 선정될 경우 비보존은 중독치료제 개발에 필요한 비임상 연구를 맡고, 현지 전문의들은 임상 2상을 진행하게 된다”고 말했다.
차백신연구소 3세대 B형간염 예방백신, 1상 CSR 수령
차백신연구소는 3세대 B형간염 예방백신 ‘CVI-HBV-002’의 임상 1상 임상시험결과보고서(CSR)를 27일 수령했다고 밝혔다.
차백신연구소는 2021년 6월 식품의약품안전처로부터 3세대 B형간염 예방백신의 국내 임상 1상 IND 승인을 받았고 2022년 11월에 만 19세 이상 65세 미만의 성인 30명에게 CVI-HBV-002 투여를 완료했다. 이후 48주 간 추적관찰하면서 안전성, 반응성, 면역원성을 평가했다.
결과보고서에 따르면 1차 지표인 혈청방어율 평가에서 1차 투여 후 29명 중 28명인 92.86%에서 혈청방어율을 보였다. 2차 투여와 3차 투여, 그리고 48주 후 시험대상자 29명 전원에게서 혈청방어율을 획득한 것을 확인했다.
차백신연구소는 CVI-HBV-002를 국내 최초로 2회 투여하는 B형간염 예방백신으로 개발할 계획이다. 백신 투여 횟수를 줄이면 예방접종 접근성이 높아져 궁극적으로 국가 보건 향상에 기여할 수 있다. 또 기존 백신에 효과를 보지 못했던 이들을 위한 백신이 될 것으로 기대하고 있다.
염정선 차백신연구소 대표는 “임상 1상의 성공적인 결과를 바탕으로, 우리나라를 포함한 2~4개국을 대상으로 한 글로벌 임상 2상을 추진할 계획”이라며 “타당성 조사를 거쳐 임상국가를 확정, 2024년 3분기 중 IND(임상시험계획)를 제출하겠다”고 말했다.
나이벡, NP-201 美 FDA 임상 Pre-IND 마쳐
펩타이드 융합 바이오 전문기업 나이벡은 자체 개발한 신약물질 ‘NP-201’을 미국 식품의약국(FDA)에서 염증성 장질환치료제로 임상 1b/2a상을 진행하기 위한 Pre-IND 과정을 성공적으로 마쳤다고 27일 밝혔다. 나이벡은 올해 하반기 NP-201에 대한 IND(임상시험계획)를 신청할 계획이다.
나이벡의 NP-201은 자체 개발한 새로운 기전의 펩타이드를 기반으로 한다. 해당 치료제는 염증 및 섬유증 치료에 탁월한 효과가 있다. 특히 염증과 섬유증의 억제뿐 아니라 손상된 세포조직을 재생시키는 효과가 있어 기존의 치료제와 차별화된 기전을 가졌다.
나이벡은 올해 1월부터 NP-201의 염증성 장질환치료제 미국 임상을 위해 FDA와 사전협의를 진행해왔다. 나이벡은 최근 FDA로부터 현재 보유 중인 NP-201의 △CMC(제조 및 품질 관리), △비임상 자료, △in vitro/in vivo(체외 체내) 자료가 염증성 장질환치료제의 임상시험 신청자료로 적절하다는 서면답변을 수령했다. 나이벡은 FDA로부터 받은 Pre-IND LETTER(사전 임상시험계획 서한)를 바탕으로 임상준비를 가속화할 방침이다.
이어 “NP-201은 염증과 섬유증에 대한 근본적인 치료가 가능할 뿐 아니라 동물실험을 통해 폐동맥고혈압에도 치료효과를 확인해 다수의 글로벌 제약사들이 주목하고 있다”라며 “특히 재생기전에 특화된 염증성장질환 치료제 개발은 지금까지 전무한 상황으로 시장 파급력도 매우 클 것”이라고 강조했다.


![월드컵까지 따냈다...스포츠산업 '생태계 파괴자' 된 빈살만[글로벌스트롱맨]](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/11/PS23110500115t.jpg)

![[포토] 폭염 속 휴식취하는 건설 근로자](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/08/PS23080100718t.jpg)






![[포토] 임성재의 우승 본능](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800425t.jpg)
![[포토]이정민 '구름 갤러리와 함께 입장'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800395t.jpg)
![[포토]파워에이드와 함께 다 마신 페트병 재활용 하세요!](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800282t.jpg)
![[포토]꽃 바다에 풍덩](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800265t.jpg)
![[포토]'어느새 여름?'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800219t.jpg)
![[포토]'역대급 엔저'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800217t.jpg)
![[포토]'취재진 앞에 선 오동운 공수처장 후보자'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800096t.jpg)
![[포토] 장동규 '볼~'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042700168t.jpg)
![[포토]박결 '가볍게 몸을 푼다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042600643t.jpg)
![[포토] 박상현 '순위 반등이 필요하다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042600223t.jpg)
